H-5.
多形黄色星細胞腫
,
退形成性多形黄色星細胞腫
Pleomorphic xanthoastrocytoma (PXA), Anaplastic PXA (APXA)
1.概要(総論)
PXAは小児と若年成人の脳の表層に発生するとても稀な星細胞腫、腫瘍細胞が様々な形状を呈する「多形性」が著しく、
しばしば細胞質内の脂肪滴により外観が黄色調を呈することが多いことが特徴の腫瘍(です。
発生頻度に性差はありません。側頭葉と前頭葉の発生が多いですが、中枢神経系のどこにでも発生します。
悪性度のグレードは世界保健機構 (WHO) により4段階に分けられており、1と2が良性、3と4が悪性で、4は癌になりますが、
PXAがグレード2、APXAがグレード3です。
この腫瘍が発生する原因はほとんどの場合不明です。神経線維腫症I型、または家族性黒色腫-星細胞腫症候群という、
家族に受け継がれる遺伝子変化がある場合は、PXAおよびAPXAを発症するリスクが報告されていますが、腫瘍が発生する頻度が高いわけではありません。
◆ 医療者向け ◆
PXAはKepesらによって1973年に初めて報告され、fibrous histiocytoma (fibrous xanthoma) of meninges などの名称で報告されていた
疾患と同じものであるとして、1979年にPXAと名付けられました(参考文献:1)。
1993年からは正式にWHO脳腫瘍分類に組み込まれ、その後にAXPAの亜型が存在することが報告され、最新のWHO2016脳腫瘍分類アップデートでは、
PXAがグレード2、APXAがグレード3となっています(参考文献:2)。
PXAとAPXAは脳や脊髄のくも膜下腔の星細胞またはその前駆細胞から発生し、星細胞腫全体に占める発生頻度は1%未満です。
側頭葉が最も多く、前頭葉が二番目に多くなります。頭頂葉、後頭葉と続き、極めてまれな部位として、小脳、脳幹、脊髄、
視床下部、松果体部、トルコ鞍、網膜などの報告もあります(参考文献:3)。
10歳代にもっとも多いですが、高齢者発生の報告もあります。
この腫瘍が発生する原因は不明ですが、BRAFV600Eの遺伝子変異が発見されることが多いことが知られています。
癌抑制遺伝子のneurofibrominに異常がある神経線維腫症I型、または癌抑制遺伝子のCDKN2Aに異常を有する家族性黒色腫-星細胞腫症候群の遺伝性疾患の場合、
PXAおよびAPXAを発症するリスクがあると報告されています(参考文献:4,5)。
小児期に多い類表皮性膠芽腫 (epithelioid glioblastoma) というグレード4の膠芽腫の亜型は、BRAFV600Eの遺伝子変異を有することが多く、
本疾患の類縁疾患である可能性が指摘されています(参考文献:6)。
【参考文献】
- Kepes JJ, et al., Pleomorphic xanthoastrocytoma: a distinctive meningocerebral glioma of young subjects with relatively favorable prognosis. A study of 12 cases. Cancer. 44: 1839-1852, 1979.
- Louis DN, et al. World Health Organization Histological Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer, France. 2016.
- Yan J, et al., Pleomorphic xanthoastrocytomas of adults: MRI features, molecular markers, and clinical outcomes. Sci Rep. 8: 14275, 2018.
- Saikali S, et al., Multicentric pleomorphic xanthoastrocytoma in a patient with neurofibromatosis type 1. Case report and review of the literature. J Neurosurg. 102: 376-381, 2005.
- Chan AK, et al., Familial melanoma-astrocytoma syndrome: synchronous diffuse astrocytoma and pleomorphic xanthoastrocytoma in a patient with germline CDKN2A/B deletion and a significant family history. Clin Neuropathol. 36: 213-221, 2017.
- Alexandrescu S, et al., Epithelioid glioblastomas and anaplastic epithelioid pleomorphic xanthoastrocytomas--same entity or first cousins? Brain Pathol. 26: 215-223, 2016.
2.症状
PXAとAPXAの症状は、腫瘍が発生する部位によって決定される局所症状と、頭蓋内圧亢進症状に分類されます。
局所症状としては、てんかん発作や痙攣を起こす可能性があり、部位によって麻痺、言語障害、感覚障害、しびれなどが起こります。
頭蓋内の容積は頭蓋骨に囲まれて限られているため、腫瘍や嚢胞の増大により正常の脳が圧迫されると頭蓋内圧が上昇します。
頭蓋内圧亢進症状には頭痛、吐き気、嘔吐などがあります。
◆ 医療者向け ◆
PXAとAPXAの症状として特異的なものはありません。
70%以上にてんかん発作が起こり、側頭葉の場合は側頭葉てんかん、前頭葉の場合は前頭葉てんかんの症状となるなど、
発生する症状は、部位によって決定されます。
2年以上の長いてんかん発作の病歴を持ち、薬剤抵抗性であるLong-term epilepsy associated tumors (LEAT)の原因となりうる腫瘍です(参考文献:1)。
腫瘍が運動野や感覚野、言語野を圧迫すれば、それによる局所徴候が発生します。腫瘍や嚢胞が増大することで頭蓋内圧亢進症状としての頭痛、
特にmorning headacheの他、吐き気、嘔吐、うっ血乳頭、複視、傾眠状態などが起こります。
【参考文献】
- Luyken C, et al., The spectrum of long-term epilepsy-associated tumors: long-term seizure and tumor outcome and neurosurgical aspects. Epilepsia. 44: 822-830, 2003.
3.検査・診断
MR検査が、腫瘍の存在を診断するためには最も有用です。
大脳の表面の髄膜に接して境界明瞭な嚢胞を伴う腫瘤として描出される像が典型的です。
嚢胞を伴うタイプのPXAでは、腫瘍や嚢胞の大きさに比較してその周囲の脳浮腫が乏しいことも特徴になります。
一方、嚢胞を伴わないタイプのPXAも半数くらい存在するとされ、嚢胞がないという理由でPXAは否定することができません。
典型例以外は画像でPXAを疑うことは困難です。
確定診断は切除した腫瘍の病理組織診断で行われます。PXAの腫瘍細胞とその核は多形性に富み、一見すると悪性度の高い腫瘍に見えますが、
細胞分裂は乏しく壊死などの悪性所見を伴わないことが特徴で、悪性腫瘍との鑑別はとても重要です。
BRAFV600Eの遺伝子変異が発見されることが多く、この遺伝子変異はPXAの診断マーカーでもあります。
APXAはPXAの特徴を持ち、さらに増殖が早く、悪性を示唆する病理組織所見を伴います。
◆ 医療者向け ◆
典型的なPXAでは、MR検査にて嚢胞の壁に腫瘍の実質部分(壁在結節)を認め、腫瘍実質部はT1強調画像で脳の灰白質よりやや低信号から等信号、
T2強調画像やFLAIR画像では高信号または混合信号の病変として描出されます。
ガドリニウム造影剤で中等度から強く造影されます(参考文献:1)。
一方、周囲の嚢胞はT1強調画像とT2強調画像では脳脊髄液とほぼ同等の信号を示し、FLAIR画像ではキサントクロミーな性状を反映して脳脊髄液よりも信号強度が
少し高くなります。
PXAでは、腫瘍や嚢胞の大きさに比較してその周囲の脳浮腫が乏しいことが特徴になります[2]。嚢胞壁は造影されることも造影されないこともあります。
単発の病変として描出されることがほとんどで、頭蓋内の転移、播種を初発時に伴うことは滅多にありません。
CTでは嚢胞は低吸収に描出され、実質部は低吸収、等吸収、高吸収など様々です(参考文献:1)。実質部に石灰化を伴うこともあります[8]。
腫瘍は血流に乏しいですが,FDG-PETでは集積が亢進しています(参考文献:2)。
確定診断は切除した腫瘍の病理組織診断で行われます。細胞密度は中等度で多形性に富み、幅の広い細胞突起を伸ばす大小の紡錘形細胞や類円形細胞や
不整な多角形細胞が充実性に増生し、核の多形性が強く、単核あるいは多核の巨細胞が出現します。
一見すると悪性度の高い腫瘍に見えますが、細胞分裂は乏しく壊死などの悪性所見を伴わないことが特徴です(参考文献:1)。
腫瘍細胞、特に大型の腫瘍細胞には細胞質には脂肪滴や硝子滴が含まれていることがあり、顕微鏡下では泡沫状淡明で、
肉眼的な割面はときに黄色調を呈しています。
細胞間には豊富なreticular fibers (好銀線維)網が形成され、血管周囲にリンパ球浸潤を認めることもあります。
免疫染色ではglial fibrillary acid protein、S-100、vimentin、reticulin、NSEが陽性で、PAS染色も陽性です。
Synaptophysinなどの神経系のマーカーも様々な頻度で陽性になります。CD34も多形細胞に陽性となります(参考文献:1)。
最も重要な特徴としてはBRAFV600Eの遺伝子変異で75%が変異陽性となります(参考文献:1)。
BRAFV600Eに変異が起こると下流のMAP kinase (mitogen-activated protein kinase)の信号伝達経路、
すなわちERK (extracellular signal-regulated kinase) の活性化がMEK(MAP/ERK kinase)の活性化に続けて起こり、
細胞分裂が促進されるため腫瘍の発生に関与していると考えられます。
APXAは、PXAが再発して悪性転化する場合と、最初からAPXAとして発生してくる場合があります。
APXAはWHO2016脳腫瘍分類アップデートで正式に定義され、核分裂像が10カ所の高倍率視野(HPF)を観察して5個以上観察されるPXAで、
壊死を伴うことや細胞密度が上昇していることを特徴とします(参考文献:1)。
APXAではBRAFV600Eの変異が陽性である患者の割合が低下します。図にPXAの画像と病理像を示します。
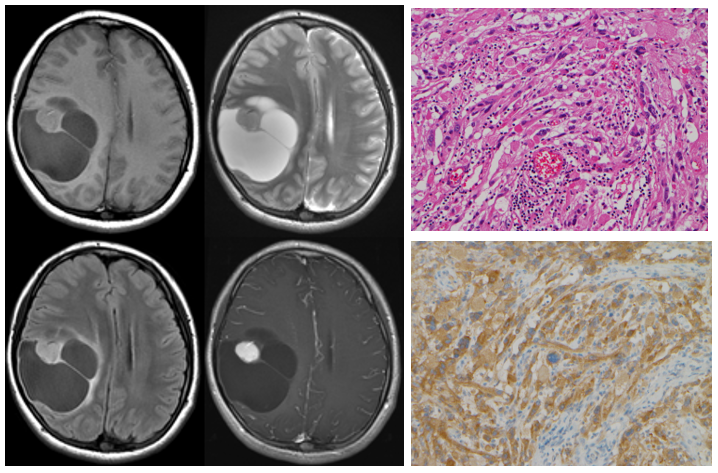
左上段:T1強調画像、左下段:FLAIR画像
右上段:T2強調画像、右下段:ガドリニウム造影後T1強調画像
早朝起床時の頭痛で発症した14歳女児のPXA。
頭頂葉に発症した多房性の嚢胞に、造影される実質部(壁在結節)を認める。病変の周囲の浮腫はわずかである。
HE染色(右上)では、多角形から紡錘形で多形性に富む腫瘍細胞が密に増殖している。腫瘍細胞間に好酸性顆粒小体が多数沈着しており、
血管周囲リンパ球浸潤も認められる。腫瘍細胞の核は大小不同を示し、多核細胞も散見される。核内偽封入体がしばしば認められるが、
核分裂像は乏しい。壊死や微小血管増殖像は見られない。腫瘍細胞はBRAFV600Eの変異蛋白に対する免疫染色(右下)で陽性である。
【参考文献】
- Louis DN, et al. World Health Organization Histological Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer, France. 2016.
- Shaikh N, et al., Pleomorphic xanthoastrocytoma: a brief review. CNS Oncol. 8: CNS39, 2019.
4.治療
PXAは手術で全摘出できた場合、治癒)が期待できます。
一方で、肉眼的に全摘出できた場合でも、腫瘍が周囲の脳に浸潤していて再発することがあります。
再発した時や残存した腫瘍が、時に悪性転化してAPXAやグレード4の膠芽腫に進行してしまうこともあります。
APXAやグレード4の膠芽腫に進行した場合は放射線治療を行うのが一般的です。脳脊髄液腔に播種(転移)が起こっていない場合は局所放射線治療を行います。
テモゾロミドを含めた抗がん剤の効果は明確には示されていません。
◆ 医療者向け ◆
1) 外科的治療:
嚢胞を伴い壁在結節の実質部分を有する典型的なPXAは手術で全摘出できる可能性が高く、
全摘出により治癒が期待できます(参考文献:2)。
一方、嚢胞壁が造影される場合や嚢胞を伴わないPXAは、発生部位によっては全摘出が困難となります。
残存がある場合でも、腫瘍の性質がおとなしい場合はほとんど増大してきません。
一方で、浸潤性格を示す場合や増殖能が高い場合は再発率が高くなります。
PXAが悪性転化した場合、APXAや膠芽腫に変化します。PXAが悪性転化した場合やAPXAに対しては、
腫瘍部に局所放射線治療を行うことが一般的です。抗がん剤は一般的には効果が乏しいと考えられています。
テモゾロミドの効果予測因子であるMGMTについても非メチル化が多く、すなわちMGMTの発現が保たれており、
効果は限定的です(参考文献:3)。
ベバシズマブは他の治療との併用で生命予後を延長するかもしれません(参考文献:1)。
播種を起こした場合、放射線治療の効果は限定的となりますが、定位放射線治療は播種病巣に効果があるかもしれません(参考文献:4)。
BRAFV600Eの遺伝子異常に対する分子標的療法は、現在開発段階にあります。薬物自体はvemurafenibやdabrafenibという悪性黒色腫などに保険適用を
取得したものが存在しており、これらの投与が再発したAPXAや、epithelioid glioblastomaに有効であったとの報告もあります(参考文献:5,6)。
単剤では皮膚の基底細胞癌の発生リスクが上昇するため、MEK阻害剤との併用が望ましく、BRAF阻害剤とMEK阻害剤併用での良好な効果も報告されていますが、
こちらも脳腫瘍の保険適用がありません(参考文献:7,8)。
現在の運用としては、遺伝子パネル検査(FoundationOne CDxがんゲノムプロファイルまたはOncoGuide NCCオンコパネル)に提出して、
BRAFV600Eの遺伝子変異が腫瘍に発生していることを証明します。
次に、がんゲノム医療中核拠点病院で患者申出療養制度を使用しての治療となります。準備期間や開始までに数カ月を要することや患者申出療養制度に要する金額、
利便性など、未解決の問題が多くあります。
【参考文献】
- Shaikh N, et al., Pleomorphic xanthoastrocytoma: a brief review. CNS Oncol. 8: CNS39, 2019.
- Pahapill PA, et al., Pleomorphic xanthoastrocytoma: case report and analysis of the literature concerning the efficacy of resection and the significance of necrosis. Neurosurgery. 38: 822-828, 1996.
- Marucci G, Morandi L. Assessment of MGMT promoter methylation status in pleomorphic xanthoastrocytoma. J Neurooncol. 105: 397-400, 2011.
- Koga T, et al., Long-term control of disseminated pleomorphic xanthoastrocytoma with anaplastic features by means of stereotactic irradiation. Neuro Oncol. 11: 446-451, 2009.
- Lee EQ, et al., Successful treatment of a progressive BRAF V600E?mutated anaplastic pleomorphic xanthoastrocytoma with vemurafenib monotherapy. J Clin Oncol 34: e87? e89, 2016.
- Ceccon G et al., Dabrafenib treatment in a patient with an epithelioid glioblastoma and BRAF V600E mutation. Int J Mol Sci. 19: 1090, 2018.
- Migliorini D, et al., BRAF/MEK double blockade in refractory anaplastic pleomorphic xanthoastrocytoma. Neurology. 88: 1291?1293, 2017.
- Kanemaru Y, et al., Dramatic response of BRAF V600E-mutant epithelioid glioblastoma to combination therapy with BRAF and MEK inhibitor: establishment and xenograft of a cell line to predict clinical efficacy. Acta Neuropathol Commun. 7: 119, 2019.
5.予後
PXAは全摘出された場合は多くが予後良好ですが、周辺に浸潤していて再発する可能性があるため、定期的な経過観察は必要です。
摘出した腫瘍の増殖速度が遅い場合は、残存部をそのまま経過観察してもあまり変化しないこともあります。
小児と成人では生命予後に明らかな差はありません。APXAや再発して膠芽腫に進行した場合の生命予後は不良です。
◆ 医療者向け ◆
PXAの5年生存率は90%、無再発生存率は70%です(参考文献:2)。
手術による全摘出を達成することが最も重要な長期予後因子となります(参考文献:3)。
そのほか、核分裂像が10カ所の高倍率視野(HPF)を観察して5個未満の場合は5年生存率が89.4%で、
5個以上の場合の55.6%と比べて予後が良好です(参考文献:2)。
壊死がない群の5年生存率は90.2%で、壊死がある群の42.2%と場合と比べて予後が良好です(参考文献:2)。
ただし、核分裂像が増加していない場合での壊死の意義については定まっていません(参考文献:1)。
BRAFV600Eの遺伝子変異がある場合は、ない場合と比較して予後が良好ですが、
多変量解析ではBRAFV600Eが陰性のPXAは症例数が少ないため確定できていません(参考文献:2)。
APXAが再発した場合や播種を起こした場合、膠芽腫などの最も悪性の腫瘍に変化した場合の予後は不良です。
類表皮性膠芽腫も播種再発を起こしやすく予後は不良です。
【参考文献】
- Louis DN, et al. World Health Organization Histological Classification of Tumours of the Central Nervous System. International Agency for Research on Cancer, France. 2016.
- Ida CM, et al., Pleomorphic xanthoastrocytoma: natural history and long-term follow-Up. Brain Pathol. 25: 575-586, 2015.
- Giannini C, et al., Pleomorphic xanthoastrocytoma: what do we really know about it? Cancer. 85: 2033-2045, 1999.





