H-6.
上衣腫
1.概要(発生頻度・発生部位)
上衣腫は、脳室の表面を覆っている脳室上衣細胞が腫瘍化したものと考えられています。
大脳半球および小脳や脳幹部、脊髄に発生する腫瘍です。
小児だけでなく成人にも見られる脳腫瘍ですが、上衣腫のうち4割は小児(15歳未満)に発症しており、
小児に多い脳腫瘍です。
脊髄を除くと、小脳や脳幹部付近の発生が60%、大脳に30%、脊髄に10%程発生します。
上衣腫は、脳の様々な場所に生じ、脊髄に発生することもあります。
頭蓋骨のなかで、大脳と小脳の間を仕切るように存在する厚い硬膜のことを「(小脳)テント」と呼び、
これよりも上方の大脳側のことを「テント上」、テントよりも下方の小脳や脳幹側のことを「テント下」
あるいは「後頭蓋窩」と言います。
小児の上衣腫はテント上、テント下のいずれにも発生しますが、テント下に生じることが比較的多いです。
一方、小児において上衣腫が脊髄に発生することはほとんどありません。
◆ 医療者向け ◆
年齢層は、乳幼児から高齢者まで幅広く発生することが知られています。
脳腫瘍全国集計(2001~2004年)では、全脳腫瘍の1.1%程度と稀な腫瘍ですが、
小児(15歳未満)の脳腫瘍の6.5%を占めています。0~4歳時までに限ると20%程度を占め、
乳幼児では重要な疾患です。
テント上下とも脳室と接している場合が多く、テント下では第4脳室、テント上では側脳室発生が多いとされています。
成人ではテント上が多く、小児では第四脳室付近の発生が多いとされています。
また、脳室とは離れた白質内や大脳皮質からの発生のものがあります。
【参考文献】
- Brain Tumor Registry of Japan (2005-2008). Neurol Med Chir (Tokyo). 2017; 57(Suppl 1):9-102.
2.症状
上衣腫だけに特有の症状はありませんが、発生した部位や大きさ等によって様々な症状をきたします。
テント上の上衣腫の場合、腫瘍のできた場所に応じた症状(身体の運動麻痺や、しびれなど)が見られることがあります。
また、腫瘍が大きい場合や、脳脊髄液の通り道を塞ぐ場所にできた場合などには、
腫瘍自体や溜まった脳脊髄液により正常脳が圧迫されたり、頭蓋内の圧力が上がってしまうことによって、
頭痛や嘔吐、意識障害といった「頭蓋内圧亢進症状」が見られることもあります。
乳児の場合には、頭囲が大きくなる原因となることもあります。また、
てんかん発作(ひきつけ)の原因となることもあります。
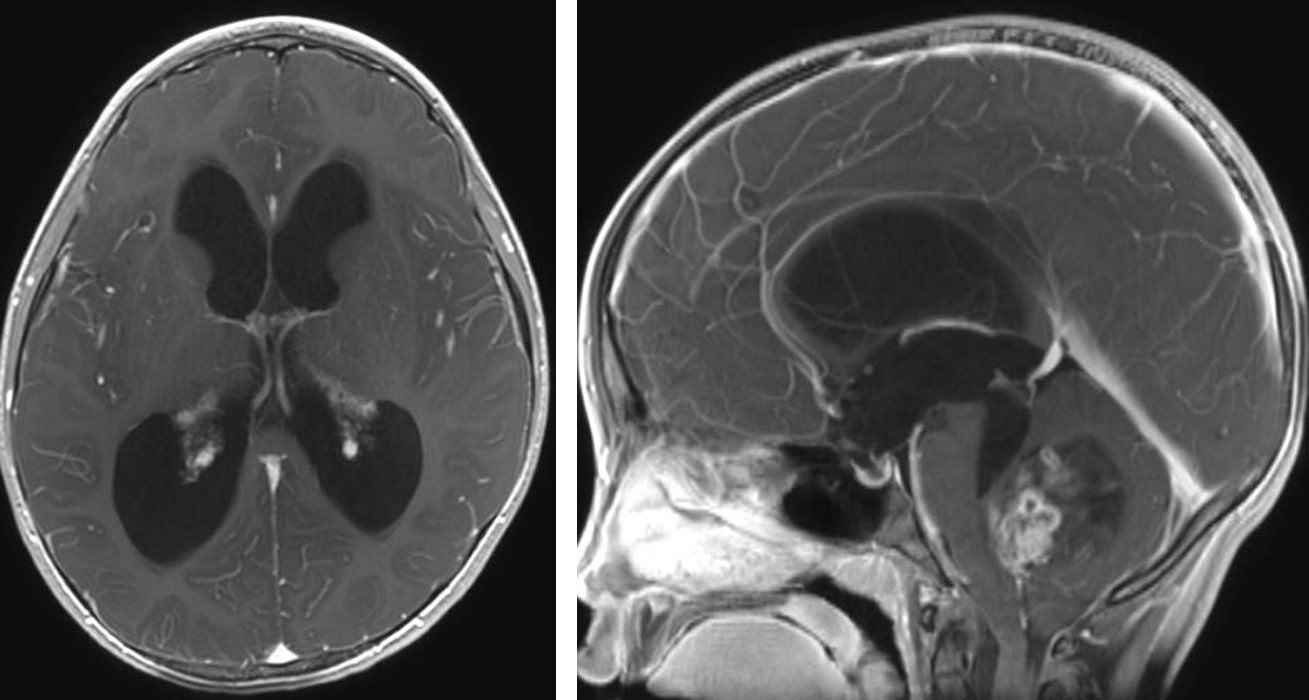
図1.後頭蓋窩上衣腫に伴う水頭症
テント下の上衣腫の症状としては、腫瘍が第4脳室内の脳脊髄液の流れを妨げることによって
水頭症が発症し、頭蓋内圧亢進症状を呈することが多いです(図1)。
また、小脳には身体をスムーズに動かせるよう調整する働きがありますので、
ふらついたり、歩行が困難となったりする症状が出現します。
また、脳神経や脳幹を圧迫されたことによる症状として、顔面の麻痺や眼球運動の症状(ものが二重に見える)や、
飲み込みにくさなどがみられることもあります。
3.検査・診断
1)画像検査
脳腫瘍の場合、まずはCT検査やMRI検査といった画像検査を行い、どのような腫瘍であるかを推測します。
しかし、脳腫瘍には多くの種類があり類似した画像所見を呈するものも少なくありません。.また、
小児の脳腫瘍の多くは、同じ種類であっても多彩な画像を示します。そのため、
画像検査だけで上衣腫であると確定診断することはできません。
確定診断のためには手術により腫瘍組織を摘出し、病理組織診断を行う必要があります。
画像検査は、腫瘍が何であるかの推測に加え、適切な手術計画を検討し、
治療方針を立てる上でも極めて重要です。
また、手術の後に残存腫瘍の有無を判定したり、
腫瘍の再発や増大の有無を確認したりするためにも画像検査は必要であり、
繰り返し行われます。時には髄液播種などの検索を行うために、頭部以外に全脊髄の検査を行うこともあります。
また、MRI検査などでは長時間じっとしておく必要があり、鎮静が必要な場合があります。
2)病理組織診断と分子診断
上衣腫は脳室上衣細胞の形態を示す腫瘍であり、手術で得られた腫瘍組織を病理学的に評価することで、
上衣腫の確定診断を得ることができます。
上衣腫は腫瘍細胞の異型性(形態的な異常の度合い)の程度によって、
WHO gradeⅡ(上衣腫)とgradeⅢ(退形成性上衣腫)に分類され、
一般的にはgradeⅢの方がより悪性度が高く予後不良とされています。
しかしgradeⅡであっても手術で全摘出するのが困難な場合には予後の悪いことがあり、
良性腫瘍とは言えません。
近年の分子遺伝学的な研究により、テント上上衣腫とテント下上衣腫は遺伝学的に異なる腫瘍であることが明らかとなり、
それぞれ2つに分類されます。
テント上の上衣腫には、RELA融合遺伝子がみられる「RELA融合陽性」と「RELA融合陰性」の2つにわけることが多く(図2)、
テント下の上衣腫は、A群(「PFA」)とB群(「PFB」)の2つに分ける方法があります(図3)。
「RELA融合陽性」と「PFA」のグループでは、他のグループと比べて予後が悪い(再発をしやすい)
可能性が示唆されており、WHO grade分類とはまた別の予後(よご)因子である可能性があります。
今後の解析が進むことで、このような分子遺伝学的検査の意義はより高まると考えられますが、
現時点では未解明な部分も多く、すべての上衣腫が必ずしもこの分類に当てはまるわけではありません。
最近のWHO診断では、病理診断名に分子診断の結果を併記する統合診断integrated diagnosisが推奨されています。
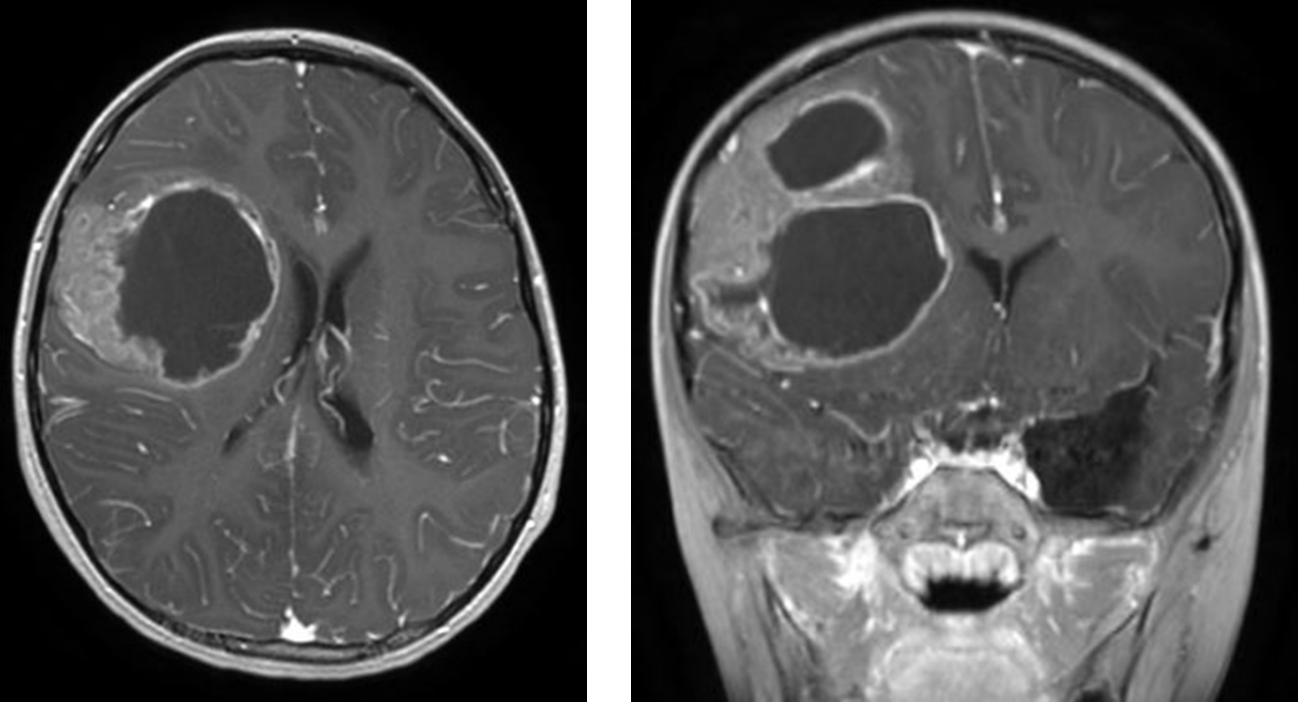
図2.RELA-fusionを有するテント上上衣腫
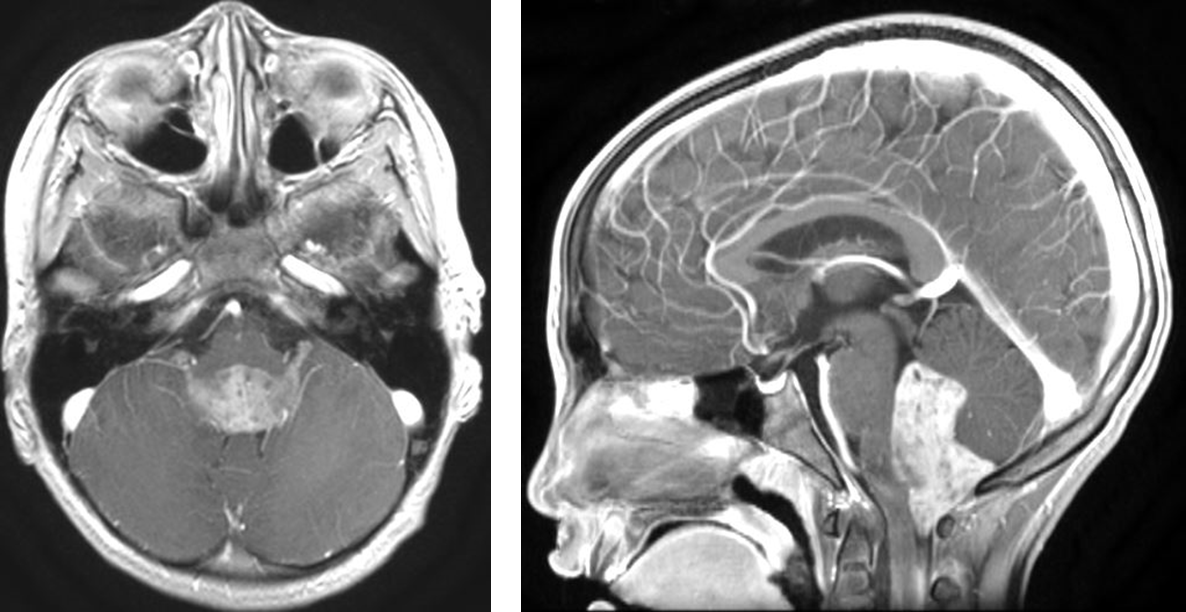
図3.第4脳室内に発生した上衣腫(infratentorial ependymoma, PFB)
◆ 医療者向け ◆
1. 画像診断
一般的には、境界明瞭な腫瘍として描出されることが多い腫瘍です。
MRIでは、T1強調画像では低信号、T2強調画像では高信号を呈することが多く、
造影効果は様々です。
腫瘍内部には石灰化や嚢胞、腫瘍内出血などがしばしば認められ、内部が不均一であることも特徴的な所見です。
一方、脳実質への広汎な浸潤や周囲の強い脳浮腫を来すことは比較的稀とされています。
第四脳室に発生した腫瘍は、ルシュカ孔から小脳橋角部へ進展する症例も見られます。
時には閉塞性水頭症を合併し、髄液播種を来たすこともありますので、全脊髄MRIも行っておくべき重要な検査です。
鑑別診断としては、後頭蓋窩発生の場合、髄芽腫やatypical teratoid/rhabdoid tumor (AT/RT)などが重要です。
テント上発生の場合は、膠芽腫や退形成性星細胞腫などの鑑別が問題となります。
2. 病理組織診断
上衣腫は脳室上衣細胞の形態を示す腫瘍であり、円柱様細胞の上皮様配列が特徴の一つです。
特徴的な細胞配列所見として、ependymal rosettesやperivascular pseudorosettesなどが挙げられます。
典型的なependymal rosettesは少数の症例にしか観察されないことが多いですが、
perivascular pseudorosettesは多くの症例で見られます。
免疫組織化学では、GFAP、EMA、S-100、vimentinなどが陽性を示します。
WHO悪性度分類では、テント上およびテント下の腫瘍は、上衣腫(gradeⅡ)と退形成性上衣腫(gradeⅢ)に分類されます。
上衣腫の悪性度に関しては、多くの論文で病理医間の不一致率を指摘する報告が多く予後因子としての見解については、
議論のあるところです。
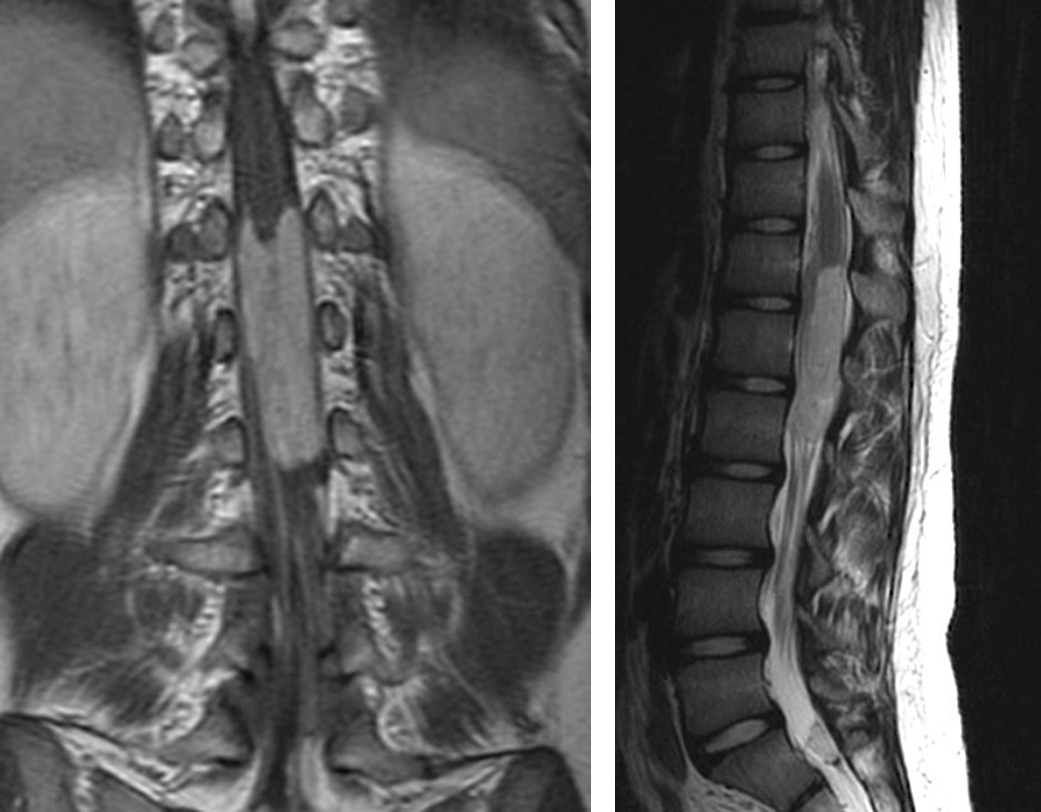
図4.脊髄円錐部、馬尾に発生した粘液乳頭状上衣腫(myxopapillary ependymoma)
特殊な上衣腫としては、subependymomaや脊髄や馬尾に発生するmyxopapillary ependymoma(図4)が挙げられますが、
これらはWHO gradeⅠで予後良好な腫瘍です。
3. 分子分類
大脳で発生する上衣腫と小脳や脳幹で発生する上衣腫は、病理学的には似ている腫瘍ですが、
近年の分子遺伝学的な研究により、テント上上衣腫とテント下上衣腫は遺伝学的に異なる腫瘍であることが明らかとなり、
別の疾患として論じられるべきと考えられています。
まず、テント下(後頭蓋窩)上衣腫は、全ゲノム的な発現プロファイルやメチル化プロファイルの違いから、
ゲノムコピーナンバー変化の乏しく、CpG islandにDNAメチル化が亢進しているグループA (posterior fossa type A: PFA)と、
6q、22qの欠失や9q、15q、18qなどの増加など1q増加以外の様々な染色体異常など、
コピーナンバー異常多型を示すグループB (posterior fossa type B: PFB)に分けられます。
PFAは男児の乳幼児に多く、WHO grade Ⅲの割合が多く、転移や再発を来たしやすいとされています。
一方,PFBは年長児や成人に多く、性差はなく、PFAに比べて予後が良好と考えられています。
テント上腫瘍に関しては、染色体粉砕(chromothripsis)により形成されるC11orf95-RELA融合遺伝子が約70%と
高頻度に認められることが報告されました。
RELA遺伝子、C11orf95遺伝子共に11番染色体長腕に存在し、NF-kBシグナルの活性化による上衣腫の発生が確認されており、
C11orf95-RELA融合遺伝子はドライバー遺伝子であることが確認されています。
またRELA融合遺伝子を認める腫瘍は、ほとんどがWHO grade Ⅲと診断されています。
cIMPACT-NOW update 7では,C11orf95の役割が強調されています。
このように分子分類は、WHO gradingとは別の独立した予後因子である可能性があります。
今後の解析が進むことで、このような分子遺伝学的検査の意義はより高まると考えられますが、
現時点では未解明な部分も多く、すべての上衣腫が必ずしもこの4分類に当てはまるわけではありません。
また、現時点では、この分子診断の結果によって治療が層別下されたり、
治療方針が変わることはありません。
【参考文献】
- Pajtler, et al. : Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell. 27(5): 728-743, 2015.
- Ellison DW, Kocak M, Figarella-Branger D, et al. Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed. 2011;10:7.
- Witt H, Mack SC, Ryzhova M, et al. Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell. 2011;20(2):143-57.
4.治療と予後
一般的に上衣腫に対しては、外科手術と放射線治療を組み合わせた治療を行います。
上衣腫においては、外科的に腫瘍を全摘出できたかどうかが予後に大きな影響を与えます。
腫瘍の発生母地や正常組織との位置関係により、手術による神経障害の悪化などのリスクを検討し、
安全にできるだけ多くの腫瘍を摘出することを脳神経外科医は目指します。
場合によっては、計画的に2回目以降の手術を行うこともあります。
しかしながら、上衣腫が脳幹や脳神経などに強く癒着している場合や、髄液腔に播種している場合など、
どうしても全摘出が困難な場合もあります。
放射線治療は、外科手術後に残存している腫瘍や摘出腔の周囲に対して行うことで、
治療効果を高めることができると考えられています。また、悪性度が高い腫瘍(gradeⅢの退形成性上衣腫)では
肉眼的全摘出された場合でも、術後に放射線治療を施行した方が、治療成績が良いとする報告が見られます。
播種性病変がない上衣腫は、同じく第4脳室に発生しやすい髄芽腫とは異なり、
照射範囲は局所照射が推奨されます。予防的な全脳全脊髄照射は行われません。
後頭蓋窩病変で摘出が困難な例や、乳幼児例などで、抗がん剤による化学療法を行うこともあります。
単独で治療成績を改善する効果は示されていませんが、腫瘍縮小効果を得ることで摘出度を高めることができたり、
3歳未満の小児に対して放射線治療の開始時期を遅らせたりすることが出来る効果があります。
◆ 医療者向け ◆
1.外科療法
上衣腫における外科的治療の主な目的は、組織採取による正確な病理診断、
分子診断とともに、可及的な腫瘍摘出です。
頭蓋内上衣腫に対する化学療法や放射線治療の有効性ついては、十分なエビデンスは確立されていませんが、
外科的摘出度が生命予後を大きく左右すると考えられます。
肉眼的全摘出を得ることで生命予後を有意に改善されることが、欧米で実施された複数のランダム化比較試験で
証明されており、全摘出の有用性が強調されています。
しかし、特に後頭蓋窩発生の上衣腫では、発生母地や伸展部、脳実質への浸潤の程度によっては、
肉眼的な全摘出は困難であることが少なくありません。
文献によると肉眼的な全摘可能な例は 54%に留まっており、全摘出できない例の多くは
周囲の脳組織(特に脳幹部)に浸潤したり、下位脳神経や主要血管を巻き込んだりしている場合であり、
これらは年少児にこのような例が多いとされています。
一方、初回手術で全摘出が得られずとも、初回手術で残存した腫瘍に対する再摘出、化学療法や放射線治療後の
再摘出(セカンドルック手術)で、より安全に手術が行える例や全摘出が得られる症例があると報告されています。
米国小児がんグループ(Children’s Oncology Group:COG)の臨床試験でも、
化学療法後のセカンドルック手術を可及的に試みる戦略の有効性について検証が行われています。
再摘出による全摘出が得られた場合も、初回手術で全摘出となった場合と同等の効果が得られることが示唆されています。
手術合併症としては、運動失調、脳神経症状(外転神経麻痺、顔面神経麻痺、嚥下困難など)、
高次脳機能障害などが多く、残存腫瘍に対する再摘出術を行う場合は、摘出術における神経症状の悪化を十分に考慮した上で、
全摘出術を目指すことが術者に求められます。
また、上衣腫の再発形式としては、播種性再発よりも局所再発が多く見られますが、
再手術により全摘出が得られる症例が6割近くあり、再発上衣腫に対する再摘出術も、
手術による神経学的な悪化に配慮した上で、適応となる場合があります。
残存腫瘍の局在については術後画像検査だけでなく術中所見も重要であり、
局所再発に対してもこれらの所見を総合的に判断し治癒を目指した治療法を検討すべきと考えます。
.
2.放射線治療
3歳以上の上衣腫の症例では、術後の放射線治療が予後の延長について有効であると考えられています。
腫瘍局在やWHO gradingに関係なく、限局性頭蓋内上衣腫に関しては、全脳全脊髄照射や全脳照射、
全脳室内照射などの照射範囲は必要なく、局所照射が推奨されます。
多くの試験で、腫瘍床への照射量は、54Gy~59.4Gy程度の線量が採用されています。
多くの試験で、残存腫瘍を認める上衣腫に対する術後放射線治療の有効性が示されています。
術後に残存腫瘍に対する局所放射線治療を追加することで生存率や無増悪生存率などの予後が改善すると考えられます。
また、肉眼的全摘出されたgradeⅢの退形成性上衣腫に関しても、術後に放射線治療を施行したほうが
OSあるいはPFSを改善するとした報告が見られます。
可及的摘出後の高線量の局所放射線療法が重要とする論文もありますが、
線量に関しては今後検討が必要なところです。
放射線治療のモダリティーとして、強度変調放射線治療(IMRT)を含む、
3次元原体放射線治療を採用する施設が多くなっています。晩期障害を防ぐために、
では照射部位を絞り込むことが可能であるため、腫瘍周辺の正常部 への被曝線量を抑えながら、
腫瘍に対する高線量の照射が可能となっています。
これらの放射線治療は欧米で盛んに行われるようになり、米国 St. Jude 病院より
上衣腫153 例に対するIMRTを用いた局所放射線療法(59.4Gy)を行い、
10年無増悪生存率77%、10年生存率88%と報告されています(Merchantら)。
放射線治療による晩期障害に関しても治療後4年間の経過観察では IQの低下は見られなかったと報告されています。
その他の報告(Conklinsら)でも、IMRTによる認知機能低下は通常の放射線治療よりも軽微であったと報告しています。
一方、日本でも使用可能となった陽子線治療も3次元原体照射以上に照射範囲の選択性が高いとされる治療ですが、
この有効性については、今後の課題と考えられます。
一方、3歳未満の症例の多くは、腫瘍制御のために放射線照射は有効である可能性がありますが、
多くの症例は晩期障害を考慮して術後照射を受けていません。放射線開始時期を3歳以降に延長するため、
化学療法などで腫瘍増大を制御することを検証する臨床試験も行われています。
3.化学療法
化学療法の予後への影響を比較した報告は極めて少なく、上衣腫の治療における化学療法の役割は不明です。
しかし、一部の症例では化学療法による腫瘍の縮小効果が得られることが知られており、
上衣腫に対し単剤で腫瘍縮小効果を認める抗腫瘍薬としてシスプラチン(CDDP)とカルボプラチン(CBDCA)が報告されています。
また、多剤併用療法としてはビンクリスチン(VCR)+エトポシド(VP-16)+シクロホスファミド(CPA)、
VCR+CPA、VCR+VP-16+CPA+CDDPなど多剤併用療法が用いられており、16-86%の奏効率が得られています。
CCG-9942 試験ではVCR+VP-16+CPA+CDDP を用いた化学療法を4サイクル行ったところ、80%で難聴、腎障害、
骨髄毒性などを含む有害事象がみられたことから、引き続く ACNS0121試験ではVCR+VP-16+CPA+CBDCAの2 サイクルへと
治療強度を軽減しています。
現時点では上衣腫の治療における化学療法の役割は腫瘍縮小効果であり、
腫瘍縮小によって全摘出遂行の割合を高めることでの治療成績を向上させることにあると考えられています。
また、術前補助化学療法として生存率への寄与については、いくつかの試験(ACNS0831試験,ACNS0831など)
でおいて検証が行われています。
本邦においては、日本小児がん研究グループ(JCCG)において、上衣腫に対する前方視的な臨床試験
(小児上衣腫に対する術後腫瘍残存程度と組織型におけるリスク分類を用いた集学的治療第Ⅱ相試験,EPN1501)
が現在登録中の状態です(2020年10月時点)。
【参考文献】
- Timmermann B, Kortmann RD, Kuhl J, et al. Combined postoperative irradiation and chemotherapy for anaplastic ependymomas in childhood: results of the German prospective trials HIT 88/89 and HIT 91. Int J Radiat Oncol Biol Phys. 2000;46(2):287-95.
- Massimino M, Solero CL, Garre ML, et al. Second-look surgery for ependymoma: the Italian experience. J Neurosurg Pediatr. 2011;8(3):246-50.
- Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009;10(3): 258-66.
- Rodriguez D, Cheung MC, Housri N, et al. Outcomes of malignant CNS ependymomas: anexamination of 2408 cases through the Surveillance, Epidemiology, and End Results (SEER) database (1973-2005). J Surg Res. 2009;156(2): 340-51.
- Metellus P, Barrie M, Figarella-Branger D, et al. Multicentric French study on adult intracranial ependymomas: prognostic factors analysis and therapeutic considerations from a cohort of 152 patients. Brain. 2007;130(Pt 5): 1338-49.
- Cage TA, Clark AJ, Aranda D, et al. A systematic review of treatment outcomes in pediatric patients with intracranial ependymomas. Journal of neurosurgery Pediatrics 2013;11:673/81.
- Garvin JH, Jr., Selch MT, Holmes E, et al. Phase II study of pre/irradiation chemotherapy for childhood intracranial ependymoma. Children's Cancer Group protocol 9942: a report from the Children's Oncology Group. Pediatric blood & cancer 2012;59:1183/9.
- Mason WP, Goldman S, Yates AJ, Boyett J, Li H, Finlay JL. Survival following intensive chemotherapy with bone marrow reconstitution for children with recurrent intracranial ependymoma//a report of the Children's Cancer Group. J Neurooncol 1998;37:135/43.




